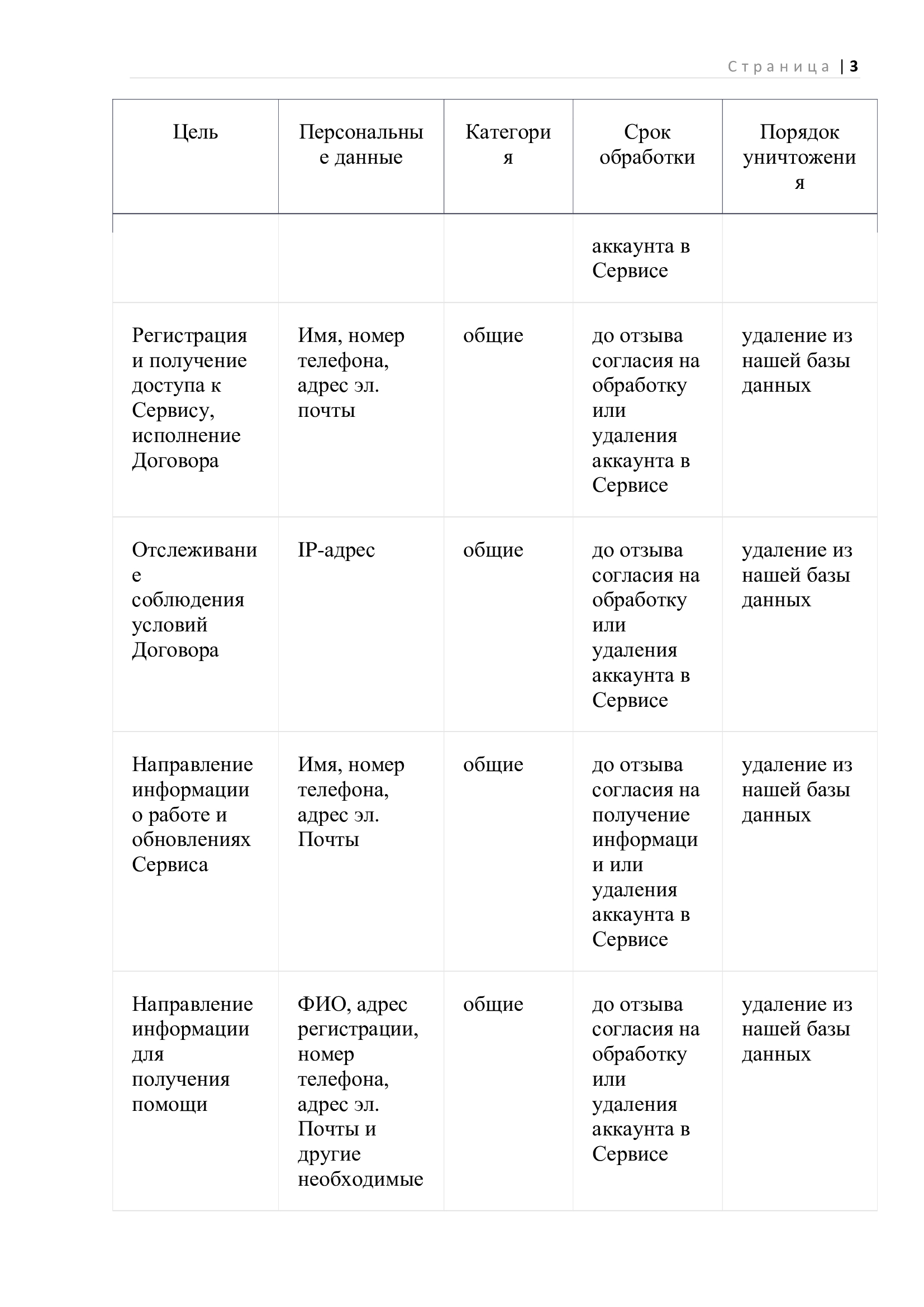
Думаю, что почти все, кто как-то сталкивался с офтальмологией, будь то врачи или пациенты, слышали, что при различных заболеваниях в глазу синтезируется много эндотелиального фактора роста сосудов (VEGF), который приводит к усилению патологических процессов, усугублению картины заболевания и выраженному ухудшению зрения больного. Поэтому, пытаясь остановить развитие заболеваний, вводят внутрь глаза вещества, блокирующие действие VEGF. Об этом мы еще обязательно напишем. А сегодня, давайте посвятим время тому, чтобы узнать, зачем вообще в глазу понадобился VEGF (рис. 1)

Рис. 1. Белок VEGF
Начнем с того, что в норме VEGF присутствует в различных тканях глаза: в конъюнктиве, сетчатке и хориоидеи. В сетчатке он обнаружен не только в стенке сосудов, но и в различных клетках, составляющих сетчатку. При этом одни клетки сетчатки могут как синтезировать, так и хранить VEGF внутри себя, как это делают клетки Мюллера, а другие, например, фоторецепторы, могут только накапливатьVEGF.
Более того, вариантов VEGF, встречающихся в организме достаточно много, и их разделили на 5 подгрупп: VEGF-A, VEGF-B, VEGF-С, VEGF-D, и плацентарный фактор роста (PlGF). Последний вместе с VEGF-A являются основными регуляторами как физиологических, так и патологических процессов в кровеносных сосудах. Из одного только гена VEGF-Aможет синтезироваться семь вариантов белков (рис. 2). Дальше мы будем немного говорить про данные, полученные на мышах, поэтому нужно знать, что у мышей все изоформы VEGF короче на одну аминокислоту.
Более того, вариантов VEGF, встречающихся в организме достаточно много, и их разделили на 5 подгрупп: VEGF-A, VEGF-B, VEGF-С, VEGF-D, и плацентарный фактор роста (PlGF). Последний вместе с VEGF-A являются основными регуляторами как физиологических, так и патологических процессов в кровеносных сосудах. Из одного только гена VEGF-Aможет синтезироваться семь вариантов белков (рис. 2). Дальше мы будем немного говорить про данные, полученные на мышах, поэтому нужно знать, что у мышей все изоформы VEGF короче на одну аминокислоту.

Рис.2. Вариативный сплайсинг VEGF
VEGF165, который подразделяется на два подтипа VEGF165а и VEGF165b, является самой распространенной формой белка, представленной в глазу человека, и наиболее важной для формирования сосудов. VEGF165а повышает проницаемость сосудов и стимулирует их рост после эпизодов ишемии (во время которых тканям глаза не хватает кислорода), он также обладает антитоксическим действием на нейроны. VEGF165b обладает противоположным действием на сосуды. Наличие других изоформ также необходимо для правильного развития ветвления сосудов. На мышах было показано, что градиент различных изоформ VEGF в сетчатке управляет уменьшением или увеличением ветвления сосудов. На рисунке 3 показаны фотографии глазного дна новорожденных мышей дикого типа (слева), в их сетчатке синтезируются различные формы VEGF:мышей, у которых в сетчатке присутствует только белок VEGF120 (в середине) и тех, в сетчатке которых встречается только белок VEGF188 (справа). Правильное удлинение и разветвление сосудов определяется пространственным градиентом изоформ VEGF, VEGF188 (красный) связывается с межклеточным веществом в непосредственной близости от клеток, синтезирующих VEGF, растворимая форма VEGF120 (зеленый) распространяется наиболее далеко от клеток, продуцирующих VEGF, и VEGF164 (черный) занимает промежуточный пространственное расположение. У мышей дикого типа наличие градиента различных изоформ VEGF контролирует ветвление крупных сосудов на более мелкие ветви. У VEGF120 мышей нормальный градиент изоформ VEGF заменяется однородным полем клеток с VEGF120, в результате чего происходит удлинение сосудов за счет уменьшения их разветвления. В отличие от них, у VEGF188 мышей градиент VEGF заменяется локальными пятнами экспрессии VEGF188, вызывая повышенное ветвление мелких сосудов.
Исходя из частоты встречаемости различных изоформ фермента и их участия в патологических процессах, были разработаны блокаторы специфичные только для VEGF165, пан-VEGFA блокаторы, и пан-VEGF блокаторы.
Исходя из частоты встречаемости различных изоформ фермента и их участия в патологических процессах, были разработаны блокаторы специфичные только для VEGF165, пан-VEGFA блокаторы, и пан-VEGF блокаторы.

Рисунок 3.
Нет VEGF, нет сосудов, нет зрения
Считается, что хориоидальные сосуды развиваются под действием пигментного эпителия сетчатки (ПЭС) и их непрерывное перестраивание в течение всей жизни тоже происходит под действием клеток пигментного эпителия сетчатки. Сосуды хориоидеи имеют пористую структуру, что обусловливает высокую проницаемость их стенок и создает условия для интенсивного обмена между пигментным эпителием и кровью. При этом «пористость»сосудов наиболее выражена на стороне, обращенной к ПЭС. VEGF отводится ведущая роль в этих эффектах действия ПЭС на сосуды хориоидеи. Эта гипотеза базируется на нескольких наблюдениях. Во-первых, клетки ПЭС стимулируют формирование трубки из хориоидальных эндотелиальных клеток в культуре. Этот процесс останавливается при добавлении в культуру клеток веществ, блокирующих действиеVEGF. Во-вторых, ПЭС активно выделяютVEGF в момент формирования хориоидальных сосудов (показано на людях), и экспрессия сохраняется в течение всей жизни (показано на людях и мышах). В-третьих, исследования культуры клеток ПЭС показывают наличие VEGF именно в базальной части клеток. Это поляризованная локализация соответствует секреции VEGF на базальной стороне ПЭС. В-четвертых, VEGFстимулирует образование «отверстий» в эндотелиальных клетках в других тканях организма.
Marneros A.G. и соавт. в своих экспериментах на мышах (рис. 4) показали необходимость VEGF в развитии сосудов хориоидеи как таковых. Они использовали трансгенных мышей, у которых отсутствует синтез VEGF в клетках пигментного эпителия сетчатки. У этих мышей не происходит развития сосудов хориоидеи. При этом отсутствие какого-либо другого ангиогенного фактора, например, фактора роста фибробластов, не приводит к таким критическим последствиям для развития хориоидеи.
Marneros A.G. и соавт. в своих экспериментах на мышах (рис. 4) показали необходимость VEGF в развитии сосудов хориоидеи как таковых. Они использовали трансгенных мышей, у которых отсутствует синтез VEGF в клетках пигментного эпителия сетчатки. У этих мышей не происходит развития сосудов хориоидеи. При этом отсутствие какого-либо другого ангиогенного фактора, например, фактора роста фибробластов, не приводит к таким критическим последствиям для развития хориоидеи.

Рис. 4. У мышей, у которых клетки пигментного эпителия сетчатки не синтезируют VEGF, не развиваются сосуды хориоидеи. Это приводит к недоразвитию глаза и полной слепоте.
Не демонизируйте роль VEGF в жизни недоношенных детей
Заживление ран на коже и в других тканях сопровождается неоваскуляризацией (процесс образования новых сосудов). Новообразованные сосуды берут начало от уже существующих сосудов, растут к месту, где не хватает кислорода, и замещают поврежденные сосуды. В сетчатке новообразованные сосуды несостоятельны и вместо того, чтоб улучшить клиническую картину ишемии, они её только ухудшают. Новообразованные сосуды могут вначале разрастаться в слоях сетчатки, но потом они начинают расти в стекловидное тело. Из-за несостоятельности стенки новообразованных сосудов и повышенной их проницаемости, из них начинает просачиваться плазма в окружающие ткани, в том числе в стекловидное тело. Плазма вызывает дегенерацию последнего, фиброзирование, образование тракций и отслойку сетчатки. Также прорастание новообразованных сосудов в стекловидное тело часто сопровождается гемофтальмом.
Как мы писали выше, VEGF регулирует развитие сосудов сетчатки в норме. Вдыхание воздуха с большим содержанием кислорода во время развития сосудов приводит к уменьшению концентрации VEGF и останавливает васкуляризацию, что приводит к запустеванию недавно образованных сосудов и образованию участков сетчатки, к которым не поступает кислород. При возвращении в условия с нормальным содержание кислорода ишемизированные области сетчатки начинают выделять повышенное количество VEGF, что приводит к развитию новообразованных сосудов. Этот процесс составляет основу патогенеза ретинопатии недоношенных. Именно из-за него опасно помещать недоношенных младенцев, сосуды сетчатки которых еще не до конца сформировались в барокамеры с высокой концентрацией кислорода. Это приводит к тому, что в дальнейшем у этих детей будут большие проблемы со зрением. Заметьте, что если соблюдены все условия содержания недоношенных младенцев в первые месяцы их жизни, то вероятность использования блокаторов VEGFфактически сводится к нулю.
Как мы писали выше, VEGF регулирует развитие сосудов сетчатки в норме. Вдыхание воздуха с большим содержанием кислорода во время развития сосудов приводит к уменьшению концентрации VEGF и останавливает васкуляризацию, что приводит к запустеванию недавно образованных сосудов и образованию участков сетчатки, к которым не поступает кислород. При возвращении в условия с нормальным содержание кислорода ишемизированные области сетчатки начинают выделять повышенное количество VEGF, что приводит к развитию новообразованных сосудов. Этот процесс составляет основу патогенеза ретинопатии недоношенных. Именно из-за него опасно помещать недоношенных младенцев, сосуды сетчатки которых еще не до конца сформировались в барокамеры с высокой концентрацией кислорода. Это приводит к тому, что в дальнейшем у этих детей будут большие проблемы со зрением. Заметьте, что если соблюдены все условия содержания недоношенных младенцев в первые месяцы их жизни, то вероятность использования блокаторов VEGFфактически сводится к нулю.
VEGF защищает нервные клетки сетчатки
Кровеносные сосуды также взаимодействуют с нервными клетками в течение развития центральной нервной системы. Например, в формирующейся сетчатке, астроциты (клетки нервной ткани, обеспечивающие жизнедеятельность нейронов) растут центробежно от центра сетчатки к её внешним слоям и тем самым обеспечивают трек для прорастания сосудов. Действительно, на начальном этапе сетчатка лишена сосудов и гипоксична, что повышает выбросVEGF астроцитами. Увеличение концентрации VEGF сопровождается ростом кровеносных сосудов и снабжением тканей кислородом, что в свою очередь, подавляет выработкуVEGF в астроцитах и стимулирует их дифференцировку. Вдобавок к регуляции процессов роста кровеносных сосудовVEGF отвечает за миграцию нервных клеток в ЦНС.
VEGF-Азащищает ганглионарные клетки сетчатки, отвечающие за передачу информации от фоторецепторов к мозгу, от гибели, вызванной нехваткой кислородаи при глаукоме.
VEGF снижает выраженность апоптоза нейронов в сетчатке. Интересно, что блокирование действияVEGF у взрослых мышей на месяц не привело к изменениям в строении сосудов сетчатки и хориоидеи, никак не повлияло на их проницаемость и строение. Однако ко второй неделе эксперимента это вызвало резкое увеличение количества клеток сетчатки, вступивших в апоптоз (в основном это были клетки Мюллера, амокриновые клетки и фоторецепторы). Через месяц наблюдали выраженное истончение сетчатки и нарушение её функций.
Из данных литературы можно сделать вывод, что блокирование всех подгрупп VEGF или изоформ VEGF-A может способствовать не только запустеванию новообразованных несостоятельных сосудов, но и вызывать повреждения нейронов сетчатки. В своём исследовании Kurihara Т. и соавт. показали, что отсутствие белков, кодируемых геном Vegfа, у мышей сопровождается полной потерей зрения. Поэтому нужно помнить, что VEGFнужен для нормального функционирования глаза, и подходить к терапии заболеваний, опирающейся на использование анти-VEGFпрепаратов, разумно.
VEGF-Азащищает ганглионарные клетки сетчатки, отвечающие за передачу информации от фоторецепторов к мозгу, от гибели, вызванной нехваткой кислородаи при глаукоме.
VEGF снижает выраженность апоптоза нейронов в сетчатке. Интересно, что блокирование действияVEGF у взрослых мышей на месяц не привело к изменениям в строении сосудов сетчатки и хориоидеи, никак не повлияло на их проницаемость и строение. Однако ко второй неделе эксперимента это вызвало резкое увеличение количества клеток сетчатки, вступивших в апоптоз (в основном это были клетки Мюллера, амокриновые клетки и фоторецепторы). Через месяц наблюдали выраженное истончение сетчатки и нарушение её функций.
Из данных литературы можно сделать вывод, что блокирование всех подгрупп VEGF или изоформ VEGF-A может способствовать не только запустеванию новообразованных несостоятельных сосудов, но и вызывать повреждения нейронов сетчатки. В своём исследовании Kurihara Т. и соавт. показали, что отсутствие белков, кодируемых геном Vegfа, у мышей сопровождается полной потерей зрения. Поэтому нужно помнить, что VEGFнужен для нормального функционирования глаза, и подходить к терапии заболеваний, опирающейся на использование анти-VEGFпрепаратов, разумно.
Список литературы:
1. Harper S.J., Bates D.O. VEGF-A splicing: the key to anti-angiogenic therapeutics? // Nat. Rev. Cancer. 2008. Vol. 8, № 11. P. 880–887.
2. Stalmans I. et al. Arteriolar and venular patterning in retinas of mice selectively expressing VEGF isoforms // J. Clin. Invest. 2002. Vol. 109, № 3. P. 327–336.
3. Saint-Geniez M. et al. Endogenous VEGF is required for visual function: Evidence for a survival role on Muller cells and photoreceptors // PLoS One. 2008. Vol. 3, № 11. P. 1–13.
4. Alon T. et al. Vascular endothelial growth factor acts as a survival factor for newly formed retinal vessels and has implications for retinopathy of prematurity. // Nat. Med. 1995. Vol. 1, № 10. P. 1024–1028.
5. Gogat K. et al. VEGF and KDR gene expression during human embryonic and fetal eye development. // Invest. Ophthalmol. Vis. Sci. 2004. Vol. 45, № 1. P. 7–14.
6. Yi X. et al. Time-course expression of vascular endothelial growth factor as related to the development of the retinochoroidal vasculature in rats. // Exp. Brain Res. 1998. Vol. 118, № 2. P. 155–160.
7. Marneros A.G. et al. Vascular endothelial growth factor expression in the retinal pigment epithelium is essential for choriocapillaris development and visual function // Am J Pathol. 2005. Vol. 167, № 5. P. 1451–1459.
8. Schwarz Q. et al. Vascular endothelial growth factor controls neuronal migration and cooperates with Sema3A to pattern distinct compartments of the facial nerve // Genes Dev. 2004. Vol. 18. P. 2822–2834.
9. Foxton R.H. et al. VEGF-A is necessary and sufficient for retinal neuroprotection in models of experimental glaucoma // Am. J. Pathol. American Society for Investigative Pathology, 2013. Vol. 182, № 4. P. 1379–1390.
10. Kurihara T. et al. Targeted deletion of Vegfa in adult mice induces vision loss // J. Clin. Invest. 2012. Vol. 122, № 11. P. 4213–4217.
2. Stalmans I. et al. Arteriolar and venular patterning in retinas of mice selectively expressing VEGF isoforms // J. Clin. Invest. 2002. Vol. 109, № 3. P. 327–336.
3. Saint-Geniez M. et al. Endogenous VEGF is required for visual function: Evidence for a survival role on Muller cells and photoreceptors // PLoS One. 2008. Vol. 3, № 11. P. 1–13.
4. Alon T. et al. Vascular endothelial growth factor acts as a survival factor for newly formed retinal vessels and has implications for retinopathy of prematurity. // Nat. Med. 1995. Vol. 1, № 10. P. 1024–1028.
5. Gogat K. et al. VEGF and KDR gene expression during human embryonic and fetal eye development. // Invest. Ophthalmol. Vis. Sci. 2004. Vol. 45, № 1. P. 7–14.
6. Yi X. et al. Time-course expression of vascular endothelial growth factor as related to the development of the retinochoroidal vasculature in rats. // Exp. Brain Res. 1998. Vol. 118, № 2. P. 155–160.
7. Marneros A.G. et al. Vascular endothelial growth factor expression in the retinal pigment epithelium is essential for choriocapillaris development and visual function // Am J Pathol. 2005. Vol. 167, № 5. P. 1451–1459.
8. Schwarz Q. et al. Vascular endothelial growth factor controls neuronal migration and cooperates with Sema3A to pattern distinct compartments of the facial nerve // Genes Dev. 2004. Vol. 18. P. 2822–2834.
9. Foxton R.H. et al. VEGF-A is necessary and sufficient for retinal neuroprotection in models of experimental glaucoma // Am. J. Pathol. American Society for Investigative Pathology, 2013. Vol. 182, № 4. P. 1379–1390.
10. Kurihara T. et al. Targeted deletion of Vegfa in adult mice induces vision loss // J. Clin. Invest. 2012. Vol. 122, № 11. P. 4213–4217.
Автор:
Марина Валерьевна Тихонович, к.м.н., врач-офтальмолог клиники микрохирургии глаза «Открытие», г. Сергиев-Посад